IPSC干细胞的技术来源是哪里?
一、iPS起源:
干细胞技术出现之前,在新药研发阶段,研究者最常用的是细胞系或动物模型,但是细胞系缺乏终末分化细胞的特性,而动物模型的重复性、可靠性比较难控制,也缺乏人类的遗传背景。2006年,诱导性多能干细胞(iPS细胞)的诞生使人们看到了使用人源细胞建立新型疾病模型研究的无限可能。
诱导性多能干细胞(也称为 iPS 细胞或 iPSC)是一种多能干细胞,可以直接从体细胞中产生。 iPSC技术由日本京都Shinya Yamanaka的实验室率先提出,他在2006年表明,引入四个特定基因(命名为Myc、Oct3/4、Sox2和Klf4),统称为Yamanaka因子,编码转录因子可以将体细胞转化为多能干细胞。他因发现成熟细胞可以重新编程成为多能细胞而与约翰·格登爵士一起获得2012年诺贝尔奖。
多能干细胞在再生医学领域大有可为。 因为它们可以无限繁殖,并产生体内所有其他细胞类型(如神经元、心脏、胰腺和肝细胞),它们代表了单一的细胞来源,可用于替代因损伤而丢失的细胞或疾病。最著名的多能干细胞类型是胚胎干细胞。 然而,由于胚胎干细胞的产生涉及破坏(或至少操纵)植入前阶段的胚胎,因此围绕它们的使用存在很多争议。而 iPSC 可以直接来源于成人组织,因此它们不仅不需要胚胎,而且可以以患者匹配的方式制造,这意味着每个人都可以拥有自己的多能干细胞系。

近几年来,iPS细胞技术快速发展,并在多种疾病的发病机制、病理过程、药物筛选等研究中发挥了重要的作用。iPS细胞的一个优点是可以在不需要人类胚胎的情况下制备得到,避开了胚胎干细胞的伦理问题和争议,另外可以较为方便的通过CRISPR / Cas9基因编辑技术修复或插入突变,产生iPS细胞同基因型的对照细胞系,在科学研究上更为严谨。利用带有基因突变病人的细胞建立iPS细胞株,并且进一步分化为多种细胞,建立疾病模型并进行致病机制研究或药物筛选等研究在国际上得到广泛应用,已有多篇文章发表在顶级期刊上。
简单讲,诱导性多功能干细胞(iPS细胞)是将一些多能遗传基因导入皮肤成纤维细胞或血液单核细胞中制造而成,让普通体细胞“初始化”,建立每个人自体的干细胞。iPS细胞在细胞形态、生长特性,干细胞标志物表达等方面与胚胎干细胞(ES细胞)非常相似。iPS细胞可以像ES细胞一样分化产生几乎所有组织器官内的细胞,且避开了ES细胞的伦理问题和争议。

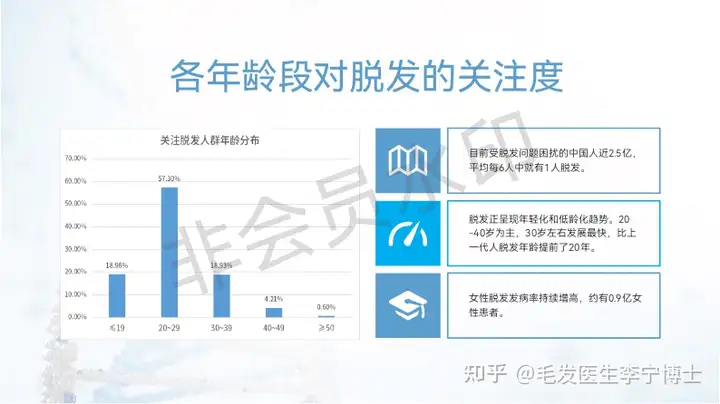
二、iPS外泌体
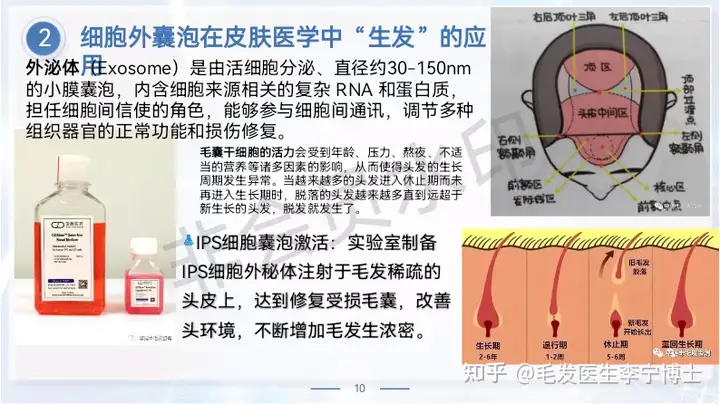
外泌体(Exosome)是由活细胞分泌、直径约30-150nm的小膜囊泡,内含细胞来源相关的复杂 RNA 和蛋白质,担任细胞间信使的角色,能够参与细胞间通讯,调节多种组织器官的正常功能和损伤修复。
干细胞外泌体来源于干细胞,具备干细胞的重要治疗作用且更安全,可以有效转运具有疾病治疗作用的RNA和蛋白质等生物活性物质,具有抑制细胞凋亡、抑制炎症反应、促进血管生成、抑制纤维化、提高组织修复潜力等重要生物学功能。另外,外泌体能够穿透血脑屏障,并且能够递送小分子药物等各种治疗分子,具有非常广阔的临床应用前景。
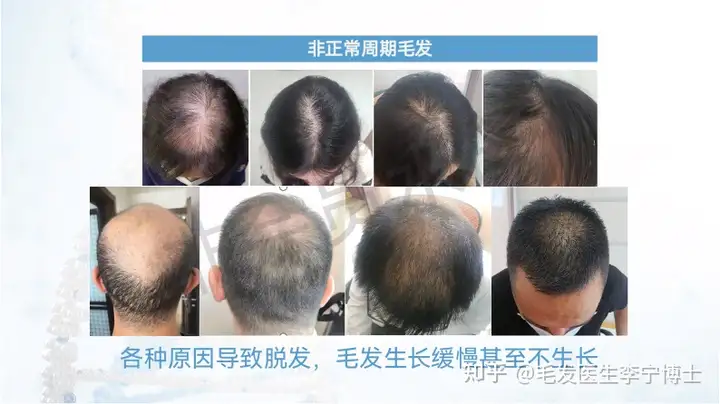






公司致力于解决目前神经系统疾病和免疫性疾病药物开发领域的关键技术障碍,全力打造全球最大的神经系统疾病患者iPS细胞库和类器官疾病模型库,建立国际领先的创新药物研发平台。公司已经为300余家国内外药物研发企业和科研机构提供了优质服务。同时,公司利用临床级干细胞及其衍生物制备的专利技术,正在开展脑卒中、复发难治性癫痫、难治性特应性皮炎等重大疾病的干细胞及其衍生物药物的临床试验。公司的目标是打造神经系统疾病药物研发的颠覆性技术平台,成为国际神经系统疾病药物研发领域的领航者。国典医药的核心科学团队来自于北京协和医学院与美国约翰霍普金斯医学院,拥有干细胞分化相关专利技术,可以从iPS细胞定向分化为新的功能细胞,包括多种类型的神经元、心肌细胞、眼部细胞等,可极大助力多种疾病的致病机制研究,并且提高新药研发的可靠性与成功率。
主要研究方向:重大神经退行性疾病和肿瘤的发病机制和治疗性靶点研究。其研究成果已经发表在70余篇国际科学杂志上,其中包括Cell (封面), Science, Nat Immunol等国际著名杂志,首次发现并命名Thorase基因,9项发明专利。

技术团队来源(国典医药),在这个领域的理论体系,能做到什么程度,与其他同类技术的核心差异化在哪里?
外泌体最大的问题,在于提纯和成分稳定。简述生发效果为何这么好,技术壁垒的核心原因是什么?
干细胞的组织再生修复能力主要是依赖它的旁分泌效应介导的,旁分泌效应是依赖于各种分泌物实现,旁分泌物种含有生长因子(如VEGF、EGF,bFGF、HGF等)和细胞因子(IL-6、IL-7、IL-8、IL-11、GM-GSF、TGF-β等),它们在组织修复过程中发生作用,干细胞旁分泌物包含:外泌体、外囊泡和其他可溶性细胞因子。其中,外泌体为干细胞旁分泌物中的,大小为30-150nm间的微小囊泡,内容物包括上百种细胞因子、各种蛋白和RNA等。外泌体可将其所携带的内容物传递给受体细胞,从而影响局部微环境并调节临近细胞蛋白的表达。
近来的研究已证实,iPS外泌体具有诸多生物学作用,如:归巢、增强细胞活力和抑制细胞凋亡、促进干细胞分化、增强干细胞迁移能力、抗炎、抗纤维化(抑制疤痕产生)、 抗氧化作用(氧自由基的还原)、促进血管形成和成纤维细胞功能和增强基质的完整性等作用,基于这些特性运用干细胞外泌体对疾病进行治疗(比如烧伤烫伤,银屑病、系统性硬皮症、糖尿病足等),既可以避免干细胞移植存在的免疫反应,也可减少潜在的促瘤性风险,同时更容易长期存储,有望实现标准化和规模化应用。生发,只是iPS外泌体诸多应用中的一方面,具体为增强细胞活力、迁移能力、抗炎等方面的综合效果。
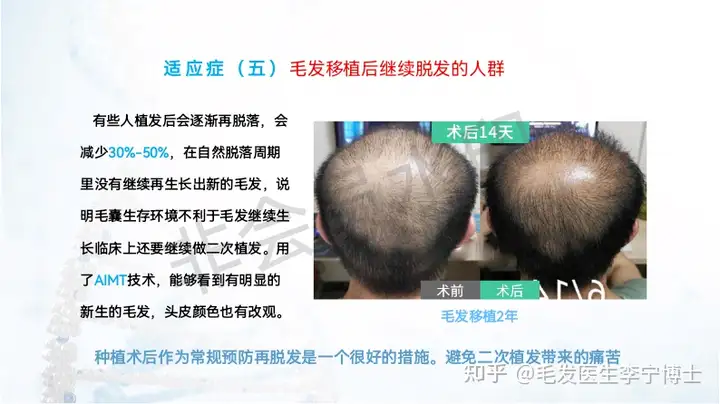
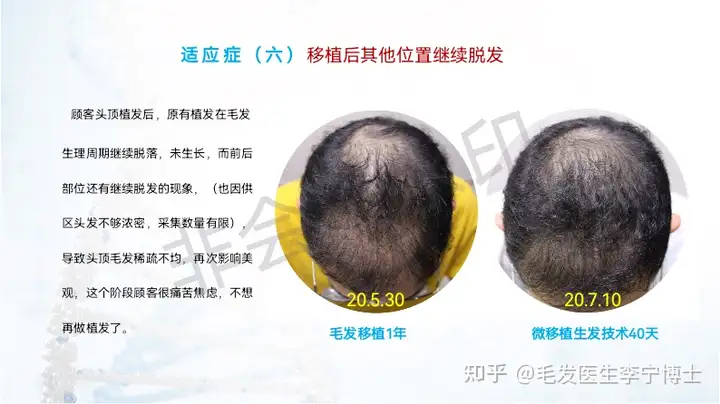
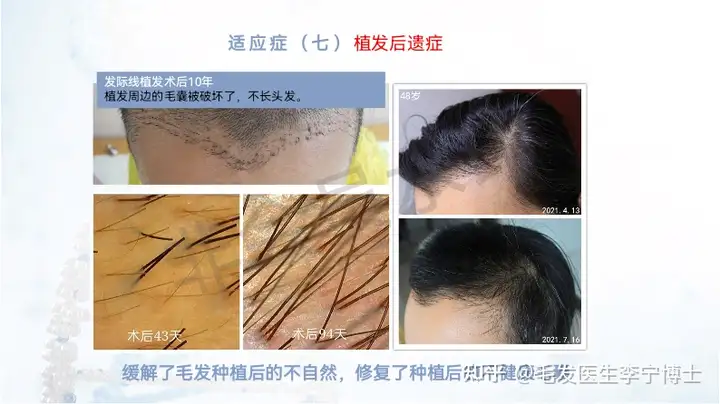
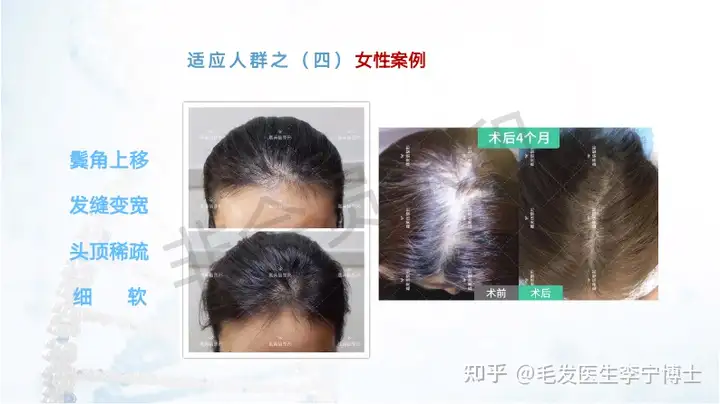
适应症人群:
1 内分泌紊乱导致的稀疏细软脱发
2 自身免疫性疾病导致的脱发
5 遗传导致的整体顽固性稀疏
6 不适用毛发移植的脱发人群
诊前预期:
1 越早干预,改善空间越大。✔️
治疗越晚价值越小。任何其它疾病也是这样的。✔️
2 明确符合现实的改善预期。✔️
脱发级别越高,改善难度越高。✔️
改善预期:
前3-4次联合治疗,基本解决头皮炎症 油腻 细软 软塌塌 掉发问题。(每月治疗1次)⚠️
6次联合生发治疗,彻底改变用户目前的脱发问题,并保持长期效果多年,日常养护也趋于正常化,不用大量用药。

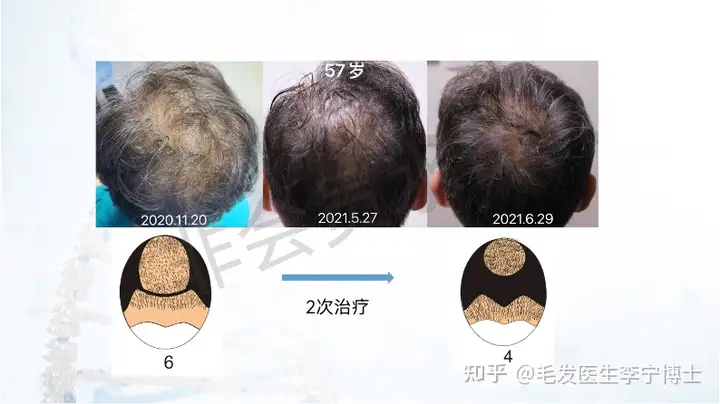
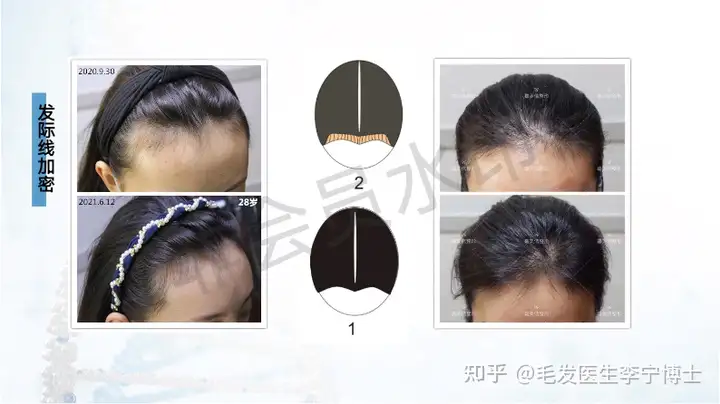
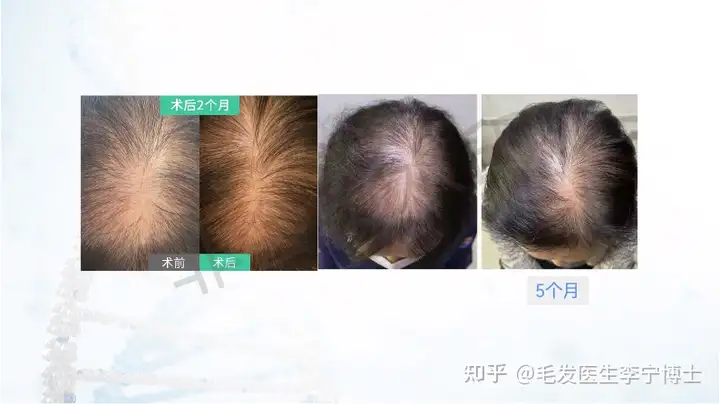
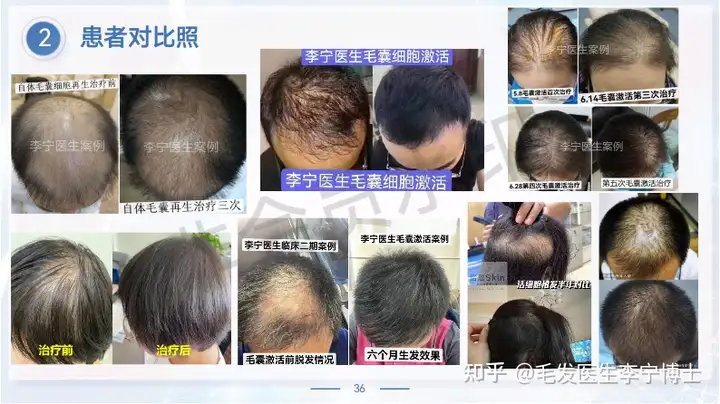
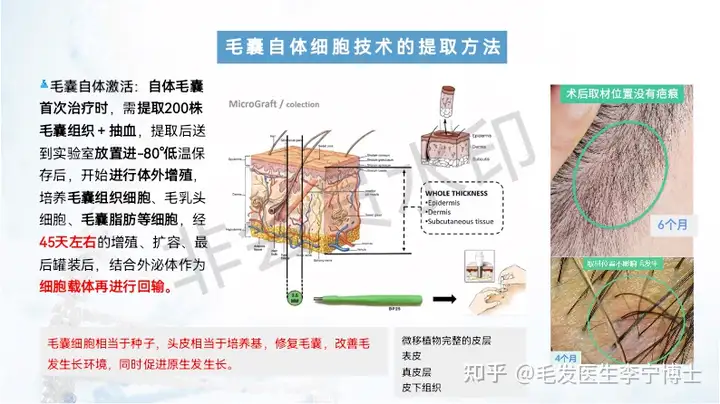
作为国内最早做毛囊细胞治疗临床应用团队,第一期实验数据,有效率90%左右。